11/19/2015執筆、12/23/2019 Yahoo Blogより移行公開
このブログの理論の根幹をなしているのが、「Kirに放射性Csがはまり込んだところで崩壊を起こしたら、オープンの形で壊れる」というテーマです。「オープンの形に固定される」という表現もしてきました。この仮説を元に、理論全体を作り上げています。
この項では、一体全体、どうやって、そんな風に、狙い通りに、Cs崩壊時に伴って、Kirの構造変化が起きると考えられるのか、ということを説明いたします。
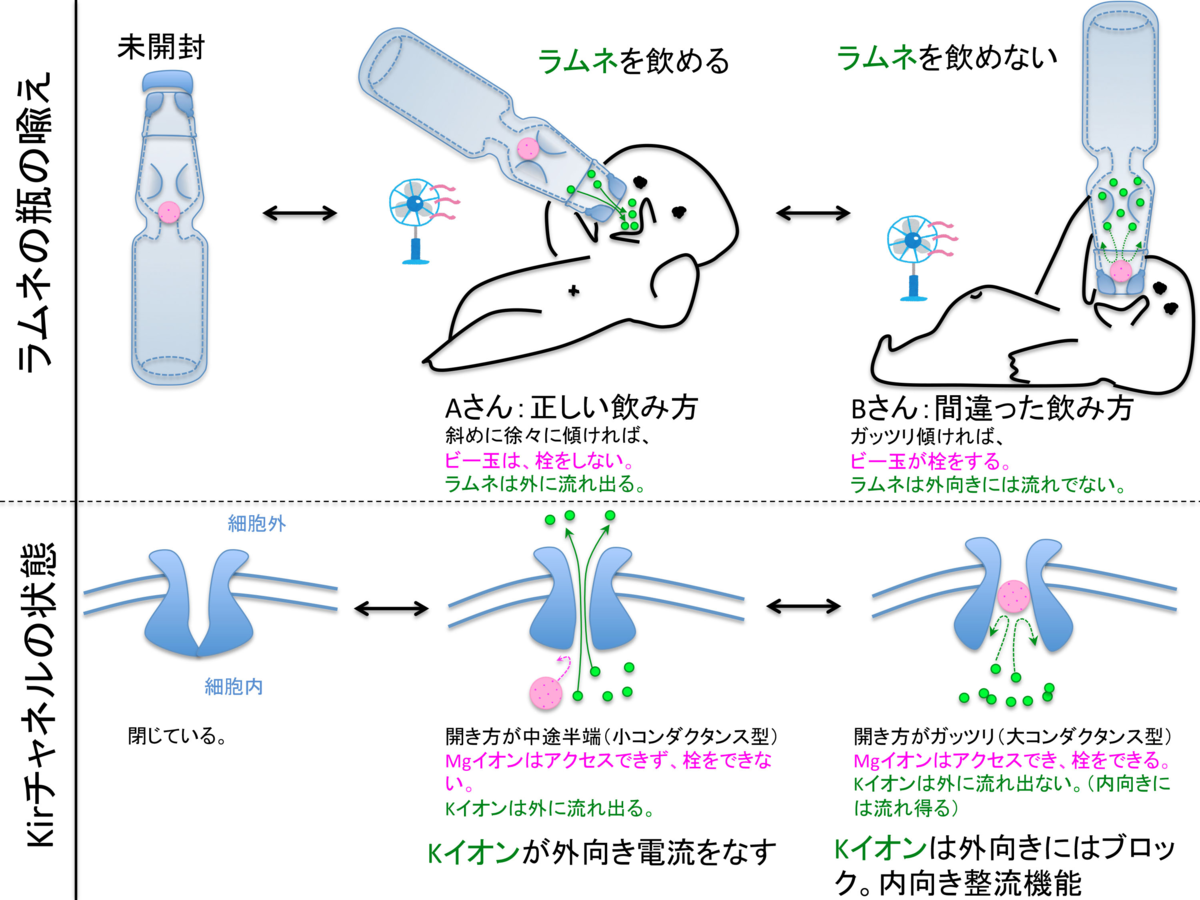
この議論に入る前に、そもそも、Kirは、もともとオープンな状態しかとらないのではないか?という誤解に関しては、別項にて議論しました。昨今は、以前の通念が覆り、Kirも、厳密な開閉の制御を受けている、という認識に変わりつつある、時代の過渡期にあたります。
では、そのことを踏まえた上で、おそらく、誰もが感じるであろう疑問というのが、セシウム崩壊時に、「そんなに都合よく、オープンの形に壊れるのか?」という点だと思います。グシャグシャに壊れて、元も子もないようなボロカスになるんじゃないのか?など、いろいろな意見があるかと思います。
この点をきちんと考察するための条件が、放射性セシウムが崩壊した時に起こる、「配位座の変化」あるいは「配位強度の変化」です。
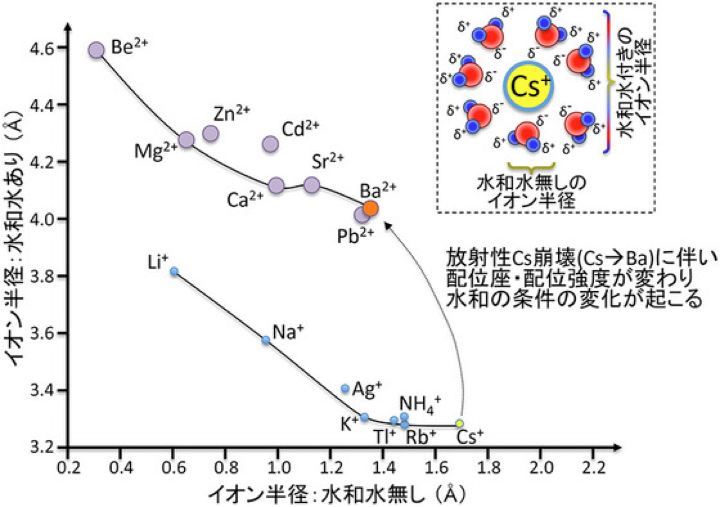
この図、教科書から撮った図を改変したものですが、一見して、なにか気がつくことはありませんか?大体、原子量の大きな原子の方が、(水和水も含めた時の)イオン半径は大きくなるのかと思いきや、全然そうでもない、というのがまず第1点(イオンが身にまとった水分子のことを、水和水と言います。水和水が、陽イオンに配位している、とも言います)。むしろ、大雑把には、逆に、原子量の大きい原子の方が、含水和水イオン半径が小さくなっているという傾向がある。もう一点は、1価のイオン(K+, Na+, Cs+など)と、2価のイオン(Mg2+, Ca2+, Ba2+など)と、異なる別々の関係性で、イオン半径が決まっていそうだ、という点。上のグラフで、大雑把に、2つの曲線に関係性が集約されている、ということです。これらの関係性は何を表しているかというと、一つには、配位強度が水和水イオン半径に重要、また、1価のイオンは、相対的には裸のままイオンを形成したがるのに対して、2価のイオンは、(より多くの)水和水を身にまとった方がハッピー、という挙動の違いなどなど。なぜかというと、2価のイオンは、それだけ、原子核のプラスのチャージが強く、近傍にあるマイナスのチャージを強く引き寄せる傾向があるから。周囲にあるマイナスのチャージといえば、水分子です。こうして、大体、2価のイオンは、6-8個くらいの水分子を身に纏いたがります。2価のイオンは、1価のイオンに比べて、「配位強度が強い」という性質を持ちます。これは、NaCl, KCl, CsClなどの塩は、水和水を通常は含まないのに対し、MgCl2, BaCl2, CaCl2, SrCl2などは、複数の水和水を含む塩を形成しやすい、という、化学の基本を思い出していただいても、納得されることかと思います。
この傾向を、よく覚えておいてください。当理論にとって大事なことで、後々の反応論の際に、必要になってきます。
(相対的に、という意味ですが、)
Cs+=単体イオンでもハッピー
Ba2+=6-8水和イオンの方がハッピー
余談になりますが、NaチャネルやKチャネルなど、1価の陽イオンのチャネルの、イオン選択部(NaチャネルならNaイオン、KチャネルならKイオン、という具合に、特異性を決めるフィルタ)の内径は、各種イオンのイオン半径に厳密にfitするよう設計されている構造です。これは、Naイオン、Kイオンなど1価の陽イオンの配位強度がそれほど強くなく、容易に水和水を脱ぎ着できるためです。一価の陽イオンは、イオンチャネルに入る時に、水和水を脱ぎ捨てるわけです。一方、2価の陽イオン用のCaチャネルやMgトランスポーターなどは、CaイオンやMgイオンに水和水が水和した、水和半径が重要になります。Kirチャネル内にも、整流機構としてのMgイオン結合部がありますが、同様の仕組みでMgを保持します。これは、2価の陽イオンは、水和水をそれほど簡単には脱ぎ着できない、という性質と関係しています。Caチャネルが同族のSrイオンなどを比較的よく通すのも、この辺りのこと、つまりサイズ選択の緩さの問題などが関係しているのでしょうね。
さて、本題に戻ります。次に議論をするのは、Kirチャネルの、どの部分にCsイオンは嵌り込むのか、というテーマです。実は、ある程度、詳しいことは既に解析されていて、165Ser, 141Thrなどのアミノ酸残基のネガティブ・チャージを(おそらくは-OHの部分のチャージを水和水のように)認識して、嵌り込むことがわかっています。
このうち、当理論の本項で議論するのは165Serについて。この、165Serというアミノ酸残基の場所というのは、非常に重要な場所にあります。具体的には、イオン選択部のフィルターから、少し細胞内方向に降りた箇所、開閉動作のための蝶番の役割を果たすGly(2つあるうちに上流側)の直近にあります。そして、この蝶番構造のGlyを挟んで、alpha-helixが約1ターンをした箇所に、Cysがあります(この関係性が極めて重要)。
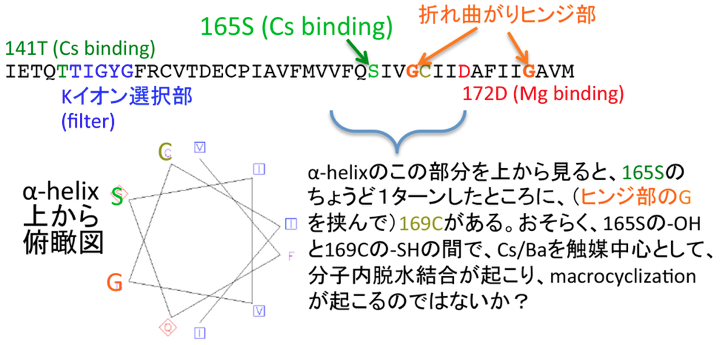
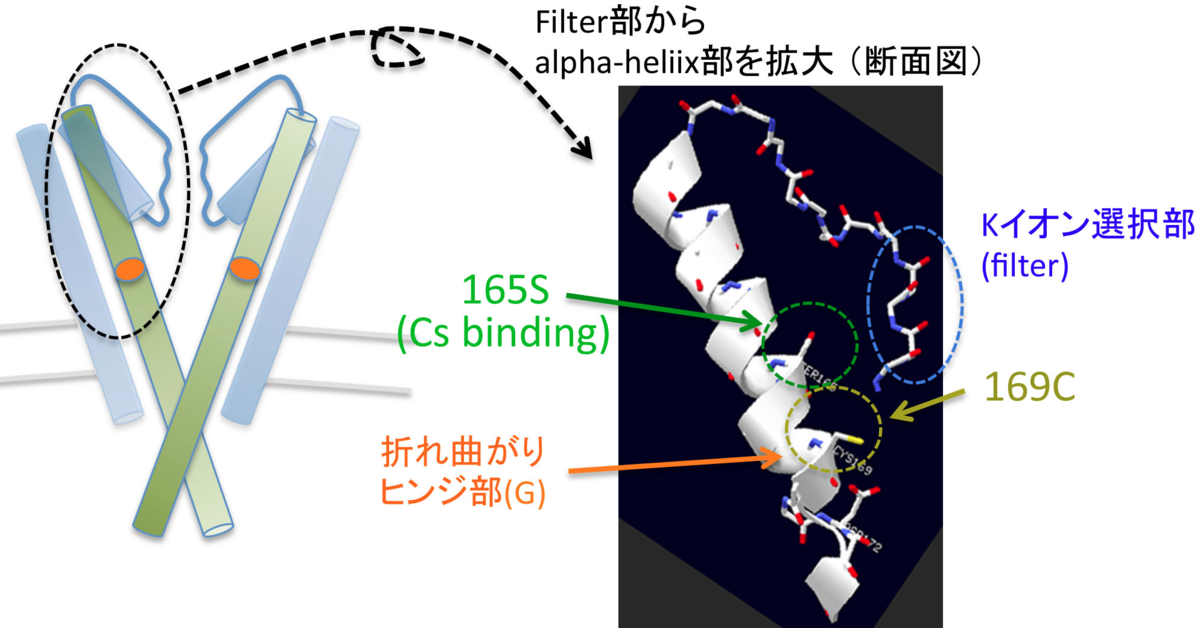
(1) もう一度、前期の情報をまとめます。Ser165という、ヒンジ部の直近のSerの-OH器が、Cs137に配位している。
(2) Cs137が崩壊し、Ba137になった途端、配位強度が強くなり、Baイオンが水和水を身に纏いたがるようになる。つまり、-OH基は、一気にBaイオンに引き寄せられる。おそらく、Ser側から引きちぎられ、周囲のHと反応し、水分子になる(脱水反応)。この時、Hを供給するのは、すぐ近傍のCysのSH基が有力な候補。スルフィド結合により、分子内macrocyclizationを起こす。この時、Baイオンは、錯体中心として、活性化されたSer残基とCysのSH基が効率よく出会うのを助け、触媒的に、働くと解釈される。
(あるいは、最終的には同じだが、一旦、Serから-OHが奪われ、α位とβ位の間で二重結合を形成し、それが近傍の-SHからHを奪い、スルフィド結合になるという反応経路も考えられる)
(3) Cs137の崩壊時のエネルギーのうち、幾分かが、この、化学反応のエネルギーに供される。可能性としては、ベータ崩壊の時よりも、むしろ、その後のγ線放出に際してのエネルギーの一部が利用されることになるのではないか(メスバウアー類似のエネルギー転移)。(注:ただし、β崩壊の際の放出電子が意味がないわけではないのかもしれない。何と言っても、触媒作用、化学反応は、物質の中の「電子の動き」である。「はぐれもの電子(=β線)」が、いま、その反応の場から、勢いよく飛び出よう、というその動向が、触媒のトリガーを引いていないなどとは、誰が断言できようか。とにかく、原子核崩壊時における触媒としての働き、これは、すべてが未知数の新しい分野なのだから)
予想される反応式
165Ser-OH --> 165Ser* +H2O (*α位とβ位の炭素の間に二重結合)
165Ser* + 169Cys-SH --> 165Ser-S-169Cys
ここまでは、化学反応の予想です。
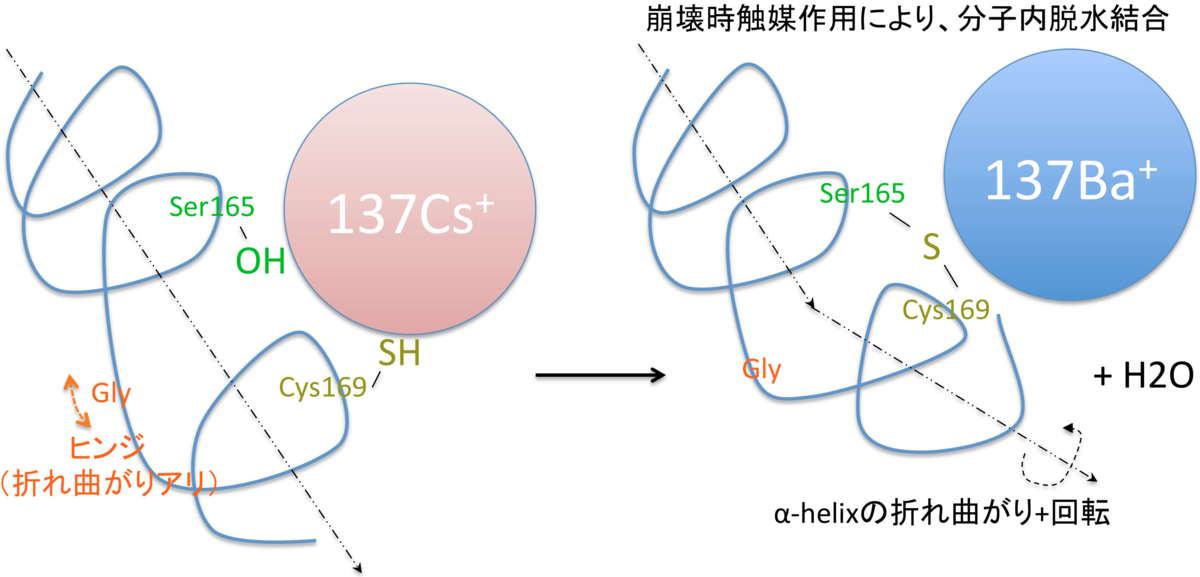
さて、次に議論するのは、その化学構造変化の結果、Kirのヒンジ部に、どのような変化が起こるのか、です。
Cysが、Serに引き寄せられるわけですから、
(i) upper ヒンジの部分が、上向きに折れ曲がる。
(ii) 同時に、alpha helixは、この部分で、約25度、上から見て反時計回り(下から見て時計回り)に回転する。(alpha helixは約3.5アミノ酸で1turnなので、SerとCysは、helix 1 turn分より、360/7度離れている。これが、互いに真ん中に比企寄せられるので、Cys以下のhelixは、360/14=約25度ほど回転する、と予想できる)。
(iii) 整流機能のためのMg結合部である172Asp(D)などは、離れているので影響を受けない。しかも、「ガッツリ開き型」になるので、Mgは嵌頓しやすくなり、整流機能をしっかりと持った、高コンダクタンス・タイプのopen-Kirとなる。(生理的条件下でのKirには、整流機能の良い高コンダクタンスのもの、整流機能を欠いているものの2グループに分かれる。これは、Kirの開き方がしっかりしているか、しょぼいかによって分かれると、個人的には理解している。PIP2結合部が、ちゃんとPIP2に結合するのか、その他のリン脂質(PPAなど)に中途半端に結合するのかによるのではないかと、個人的には理解している)。
(iv) 同様に、Kチャネルの特徴的配列であるイオン選択部(filter)も、影響は受けず、Kチャネルとして働き続ける。
実は、これらの変化、まさに、Kirチャネルが、close-->openにとる時と、ほぼ同じ、上方への折れ曲がりと、alpha helixの回転角度なのです。(下図引用:)
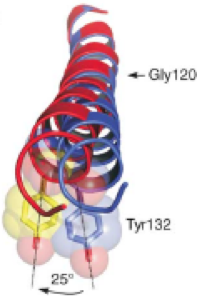
ここまでのまとめ:
Cs137崩壊時の配位座の変化、配位強度の変化のため、Kir2.1内のCs嵌頓部位で、Cs/Baを錯体中心とした、化学触媒作用位よる、化学反応が起きる。165Serと169Cysの間で脱水結合が起こり、macrocyclizationが起こる。その結果、Kir2.1は、開閉動作と全く同じ3次元構造変化をし、オープンの状態に固定される。この際のopen角度は、「しっかりオープン」の形状を取り、Mgによる整流機能結合部位へのアクセスは良好なフォームとなり、整流機能を保つ高コンダクタンス型オープン形状となる、と推定される。
<<GFPの分子内脱水結合反応などとの類似>>
下村脩先生が、緑色傾向タンパクを1960年代にオワンクラゲの中からみつけられ、このGFPは、いまや、医学生物学のありとあらゆる分野になくてはならない大事なツールとなりました。医学者でもきちんと認識しておられない、方も時々おられるかもしれませんが、下村先生の初期の貢献は、GFPを発見したばかりではなく、その蛍光核の構造をいち早く予測されておられたという点にもあります。この予測が極めて正しかったからこそ、その後、GFPの立体構造を決定する際の大きなヒントにもなり、GFPが蛍光を発する時に、自己脱水結合と酸化反応だけで十分であり、ほかに基質や酵素の助けが必要ないのだ、という、理想的な蛍光ツールとしての条件を満たすことが分かり、PrasherやChalfieらが、実際にこのGFPを使ってみようと言う、大きなモチベーションへとつながった訳です。
では、その、「自己脱水結合」は、どんな風に反応が行われているのでしょうか。タンパクの立体構造で見てみましょう。
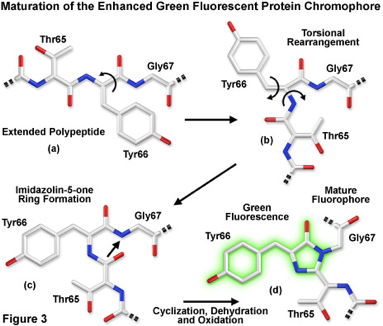
今回議論しているKirの、自己分子内脱水結合というのは、これとある意味似た、自己分子内アミノ酸残基の反応です。
タンパクの中の、アミノ酸同士の、自己脱水結合のような反応というのは、決して稀なイベントではなく、生体内で普通に行われていることでもあります。
また、製薬の分野では日常的に行われている化学反応の一つで、cyclosporin Aなどは、やはり、自己分子内macrocyclizationの化学反応を経て合成されます。
最後にまとめ:
配位座の変化が、生体分子に影響を及ぼすためには、(1)生体分子の中で固定、(2)隣接した配位子(アミノ酸残基)と金属錯体構造をとる、(3)放射性元素崩壊時に、配位座・配位強度が変化する。この3点です。
いずれも、古典的放射線理論が、見逃していたパラメーターで、当然、「物質としての放射性元素」の挙動を考えた時、先入観のない目で放射性セシウムイオンの挙動を見つめた時、誰もが考えなければならないポイントなのではないでしょうか?
もういちど書きます。固定、隣接、配位座の変化。これが、物質の挙動として大事なのだ、というのが当理論の一番の本質です。つまり、固定のために、エネルギー伝達が効率良く行われる。固定・隣接のために、触媒として働きうる。配位座の変化により、特定の化学反応を促進しうる。